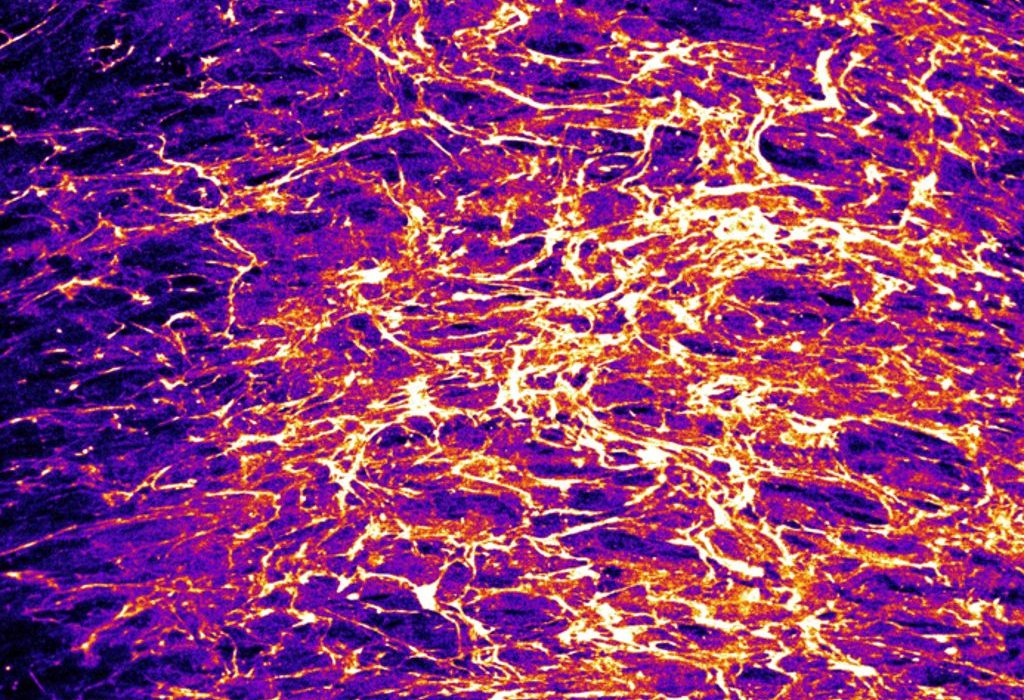
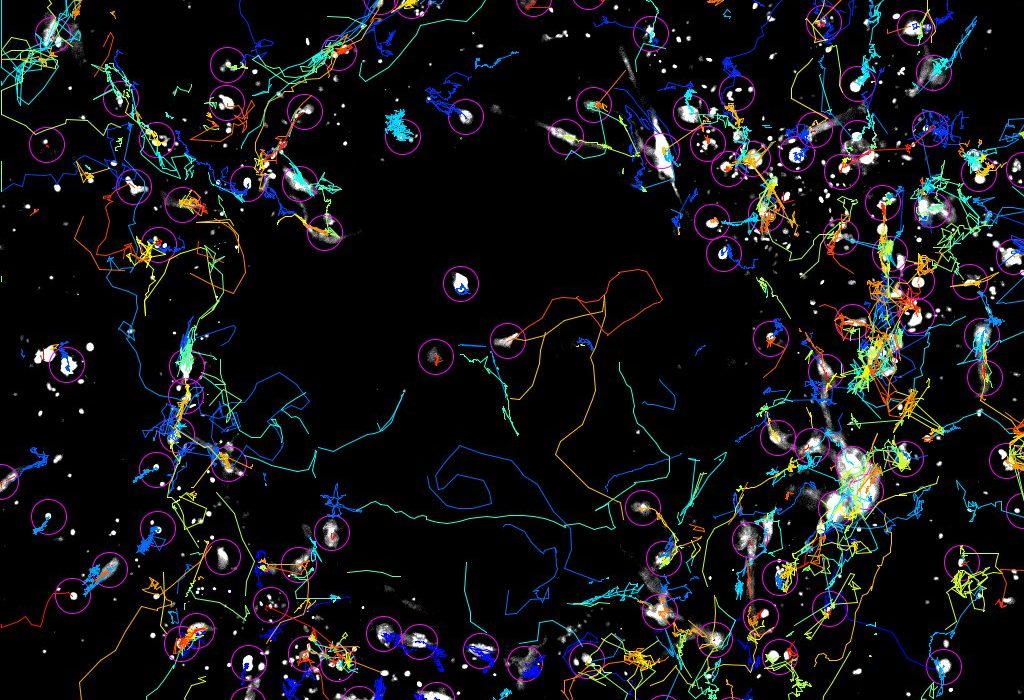
Nuestra investigación se centra en descubrir cómo la mecanosensibilidad estromal determina la organización espacial y la interacción celular en tejidos sanos y patológicos.
Nuestro laboratorio estudia:
- La mecanosensación celular (cómo las células perciben y responden a las señales mecánicas de su entorno).
- Cómo las propiedades físicas, la composición y la arquitectura de los tejidos y los tumores impulsan la migración celular y la comunicación intercelular.
Nuestros ensayos combinan la biología celular y molecular con la fabricación de microfluidos, el micromodelado de proteínas, la obtención de imágenes de células vivas, los hidrogeles con rigidez ajustable y la microscopía de fuerza de tracción.
Mediante estos enfoques, diseñamos plataformas originales similares a los tejidos con control espacial y temporal del crecimiento celular, la migración celular, la comunicación intercelular y la detección de la rigidez.
Nuestros proyectos actuales se centran en:
- Descifrar las propiedades mecánicas del microambiente tumoral (arquitectura y composición) que influyen en la metástasis del cáncer.
- Comprender cómo la arquitectura de la matriz extracelular y sus propiedades mecánicas afectan a la migración de las células inmunitarias en contextos fisiológicos y patológicos.
- La implementación de un dispositivo on chip para evaluar las respuestas inflamatorias en tumores sólidos para probar la eficacia de las inmunoterapias.
Nuestro grupo fomenta las colaboraciones con los sectores público y privado para desarrollar plataformas innovadoras de ensayo de fármacos multicelulares.
Presentación
Conócenos mejor
Personal de investigación
El equipo que lo hace posible
Anna Labernadie
alabernadie@cipf.es
Maria Paz Rubio Rodriguez
mprubio@cipf.es
Publicaciones
Nuestro aporte a la ciencia
Targeted immunotherapy against distinct cancer-associated fibroblasts overcomes treatment resistance in refractory HER2+ breast tumors.
Rivas EI, Linares J, Zwick M, Gómez-Llonin A, Guiu M, Labernadie A, Badia-Ramentol J, Lladó A, Bardia L, Pérez-Núñez I, Martínez-Ciarpaglini C, Tarazona N, Sallent-Aragay A, Garrido M, Celià-Terrassa T, Burgués O, Gomis RR, Albanell J and Calon A
Nature Communications, 2022 Sep, DOI: 10.1038/s41467-022-32782-3, Vol. 13, pag. 5310-5310
CAFs and Cancer Cells Co-Migration in 3D Spheroid Invasion Assay.
Conti S, Kato T, Park D, Sahai E, Trepat X and Labernadie A
Methods In Molecular Biology, 2021 Jan, DOI: 10.1007/978-1-0716-0779-4_19, Vol. 2179, pag. 243-256
Extracellular matrix anisotropy is determined by TFAP2C-dependent regulation of cell collisions.
Park D, Wershof E, Boeing S, Labernadie A, Jenkins RP, George S, Trepat X, Bates PA and Sahai E
NATURE MATERIALS, 2020 Feb, DOI: 10.1038/s41563-019-0504-3, Vol. 19, pag. 227-238
A mechanically active heterotypic E-cadherin/N-cadherin adhesion enables fibroblasts to drive cancer cell invasion.
Labernadie A, Kato T, Brugués A, Serra-Picamal X, Derzsi S, Arwert E, Weston A, González-Tarragó V, Elosegui-Artola A, Albertazzi L, Alcaraz J, Roca-Cusachs P, Sahai E and Trepat X
NATURE CELL BIOLOGY, 2017 Mar, DOI: 10.1038/ncb3478, Vol. 19, pag. 224-237
Protrusion force microscopy reveals oscillatory force generation and mechanosensing activity of human macrophage podosomes.
Labernadie A, Bouissou A, Delobelle P, Balor S, Voituriez R, Proag A, Fourquaux I, Thibault C, Vieu C, Poincloux R, Charrière GM and Maridonneau-Parini I
Nature Communications, 2014 Nov, DOI: 10.1038/ncomms6343, Vol. 5, pag. 5343-5343
FONDOS
Gracias por apoyarnos