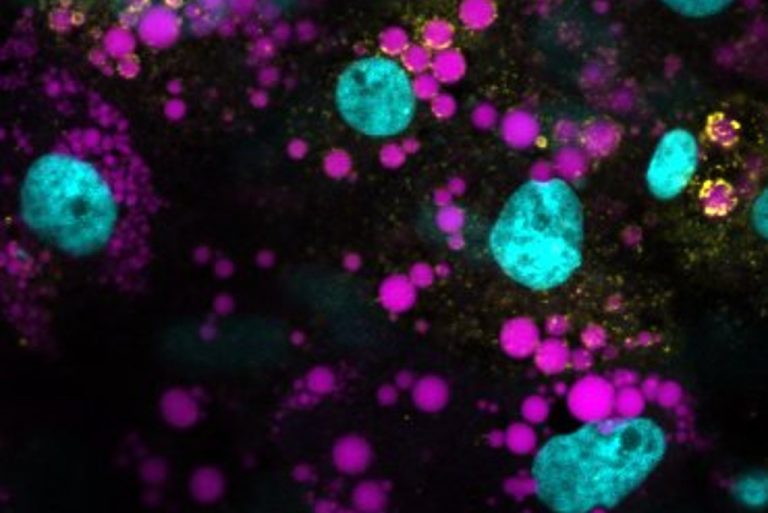
The TVPLab
Nuestro programa de investigación investiga los mecanismos moleculares implicados en el control del gasto energético, la deposición de grasas y los mecanismos que controlan la partición de la energía hacia la oxidación o el almacenamiento. Las preguntas que intentamos responder son:
- Cómo se relaciona la expansión del tejido adiposo con el desarrollo del Síndrome Metabólico.
- Como ila lipotoxicidad y / o los cambios en las adipocinas secretadas por el tejido adiposo afectan la sensibilidad a la insulina en otros órganos como el músculo esquelético, el corazón, el hígado, el cerebro, las células beta y los macrófagos.
- Si las modificaciones en la adipogénesis y la remodelación del tejido adiposo pueden ser buenas estrategias para mejorar los efectos metabólicos asociados con la obesidad.
- Los mecanismos moleculares que controlan el gasto energético y la activación de la grasa parda.
- Si la modulación de la partición de nutrientes hacia la oxidación de ácidos grasos en el músculo esquelético y lejos del almacenamiento en el tejido adiposo puede prevenir los devastadores efectos metabólicos de la obesidad.
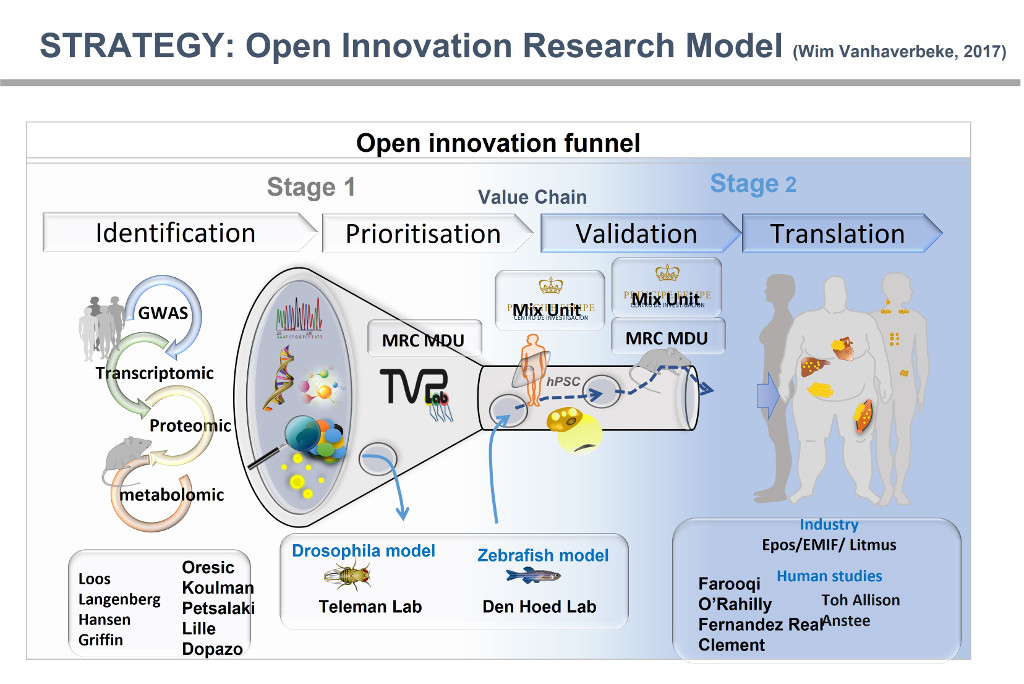
Abordar estos desafíos es una tarea abrumadora que requiere la modulación de mecanismos altamente integrados y complejos de homeostasis energética diseñados para prevenir los balances energéticos negativos. De acuerdo con este concepto integrado de homeostasis energética, mi laboratorio está utilizando un enfoque de Fisiología Integrada que se basa en gran medida en la generación y el fenotipado detallado in vivo de organismos genéticamente modificados. Junto con el enfoque de Biología de Sistemas que integra análisis transcriptómico y lipidómico, utilizando bioinformática para identificar redes metabólicas de lípidos específicos de órganos relevantes para la resistencia a la insulina y las enfermedades metabólicas.
Presentación
Conócenos mejor
Personal de investigación
El equipo que lo hace posible
Antonio Vidal Puig
avidal-puig@cipf.es
Stefania Carobbio
scarobbio@cipf.es
Publicaciones
Nuestro aporte a la ciencia
SREBP1-induced fatty acid synthesis depletes macrophages antioxidant defences to promote their alternative activation.
Bidault G, Virtue S, Petkevicius K, Jolin HE, Dugourd A, Guénantin AC, Leggat J, Mahler-Araujo B, Lam BYH, Ma MK, Dale M, Carobbio S, Kaser A, Fallon PG, Saez-Rodriguez J, McKenzie ANJ and Vidal-Puig A
Nature Metabolism, 2021 Sep, DOI: 10.1038/s42255-021-00440-5, Vol. 3, pag. 1150-1162
Allostatic hypermetabolic response in PGC1a/ß heterozygote mouse despite mitochondrial defects.
Rodriguez-Cuenca S, Lelliot CJ, Campbell M, Peddinti G, Martinez-Uña M, Ingvorsen C, Dias AR, Relat J, Mora S, Hyötyläinen T, Zorzano A, Orešic M, Bjursell M, Bohlooly-Y M, Lindén D and Vidal-Puig A
FASEB JOURNAL, 2021 Sep, DOI: 10.1096/fj.202100262RR, Vol. 35, pag.
Unraveling the Developmental Roadmap toward Human Brown Adipose Tissue
S. CAROBBIO, A. GUENANTIN, M. BAHRI, S. RODRIGUEZ-FDEZ, F. HONIG, I. KAMZOLAS, I. SAMUELSON, K. LONG, S. AWAD, D. LUKOVIC, S. ERCEG, A. BASSETT, S. MENDJAN, L. VALLIER, B. ROSEN, D. CHIARUGI and A. VIDAL-PUIG
Stem Cell Reports, 2021 Mar, DOI: 10.1016/j.stemcr.2021.01.013, Vol. 16, pag. 641-655
Bone morphogenetic protein 8B promotes the progression of non-alcoholic steatohepatitis.
Vacca M, Leslie J, Virtue S, Lam BYH, Govaere O, Tiniakos D, Snow S, Davies S, Petkevicius K, Tong Z, Peirce V, Nielsen MJ, Ament Z, Li W, Kostrzewski T, Leeming DJ, Ratziu V, Allison MED, Anstee QM, Griffin JL, Oakley F and Vidal-Puig A
Nature Metabolism, 2020 Jun, DOI: 10.1038/s42255-020-0214-9, Vol. 2, pag. 514-531
Adipocyte-secreted BMP8b mediates adrenergic-induced remodeling of the neuro-vascular network in adipose tissue.
Pellegrinelli V, Peirce VJ, Howard L, Virtue S, Türei D, Senzacqua M, Frontini A, Dalley JW, Horton AR, Bidault G, Severi I, Whittle A, Rahmouni K, Saez-Rodriguez J, Cinti S, Davies AM and Vidal-Puig A
Nature Communications, 2018 Nov, DOI: 10.1038/s41467-018-07453-x, Vol. 9, pag. 4974-4974
FONDOS
Gracias por apoyarnos