Para avanzar en nuestra comprensión de la resistencia al tratamiento y la progresión del cáncer, investigamos cómo se modulan las vías de muerte celular.
Las células están constantemente expuestas a varios estímulos que pueden alterar su homeostasis. Para mantener su supervivencia, las células han desarrollado mecanismos complejos para responder a diferentes tipos de estrés.
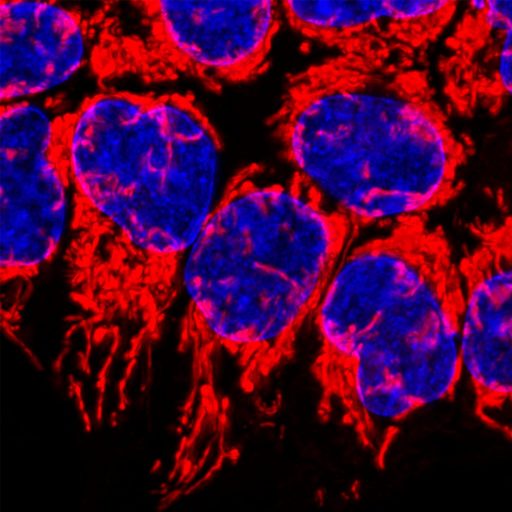
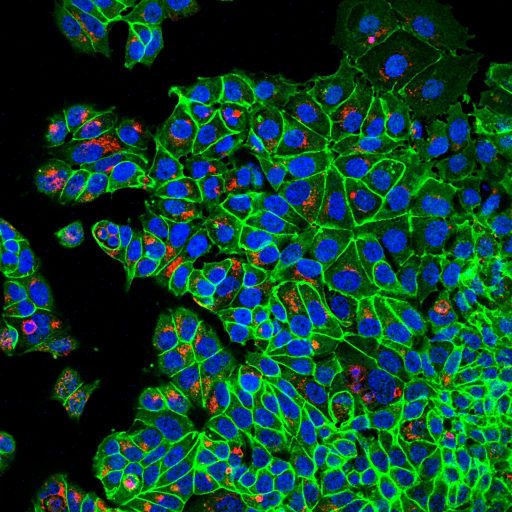
En nuestro laboratorio investigamos las vías de muerte celular mediante el uso de modelos 2D/3D y diversas técnicas de microscopía. Una de nuestras principales áreas de investigación se centra en explorar los roles alternativos de las proteínas BCL2. Estudios recientes han demostrado que estas proteínas regulan múltiples vías más allá de la apoptosis intrínseca, incluyendo el metabolismo mitocondrial. Nuestro objetivo es caracterizar las distintas funciones de las proteínas BCL2 en el cáncer y su relevancia en la resistencia al tratamiento y supervivencia.
Otra área de investigación se enfoca en la entosis, una vía de muerte celular que permite a las células de cancer invadir activamente a otras células homotípicas. Si bien la entosis proporciona una ventaja de supervivencia para la célula huésped, tambien puede eliminar a la célula internalizada. Nuestro objetivo es investigar la importancia de la entosis y la muerte celular entótica en el contexto del cáncer, identificar nuevos estresores y estímulos que induzcan este proceso y descubrir herramientas químicas para modular la entosis.
Presentación
Conócenos mejor
Personal de investigación
El equipo que lo hace posible
Federico Lucantoni
flucantoni@cipf.es
Alberto Hernandez Cano
ahernandez@cipf.es
Domingo Gil
dgil@cipf.es
Virginia Rejas
vrejas@cipf.es
Publicaciones
Nuestro aporte a la ciencia
Implication of autophagy in the antifibrogenic effect of Rilpivirine: when more is less.
Lucantoni F, Benedicto AM, Gruevska A, Moragrega ÁB, Fuster-Martínez I, Esplugues JV, Blas-García A and Apostolova N
Cell Death & Disease, 2022 Apr, DOI: 10.1038/s41419-022-04789-7, Vol. 13, pag. 385-385
BCL(X)L and BCL2 increase mitochondrial dynamics in breast cancer cell: Evidence from functional and genetic studies.
Lucantoni F, Salvucci M, Dussmann H and Prehn JHM
BIOCHIMICA ET BIOPHYSICA ACTA-MOLECULAR CELL RESEARCH, 2021 Sep, DOI: 10.1016/j.bbamcr.2021.119095, Vol. 1868, pag. 119095-119095
BCL(X)L and BCL2 increase the metabolic fitness of breast cancer cells: a single-cell imaging study.
Lucantoni F, Salvucci M, Düssmann H, Lindner AU, Lambrechts D and Prehn JHM
CELL DEATH AND DIFFERENTIATION, 2021 May, DOI: 10.1038/s41418-020-00683-x, Vol. 28, pag. 1512-1531
Metabolic Targeting of Breast Cancer Cells With the 2-Deoxy-D-Glucose and the Mitochondrial Bioenergetics Inhibitor MDIVI-1.
Lucantoni F, Dussmann H and Prehn JHM
Frontiers in Cell and Developmental Biology, 2018 Sep, DOI: 10.3389/fcell.2018.00113, Vol. 6, pag. 113-113
Systems modeling accurately predicts responses to genotoxic agents and their synergism with BCL-2 inhibitors in triple negative breast cancer cells.
Lucantoni F, Lindner AU, O'Donovan N, Düssmann H and Prehn JHM
Cell Death & Disease, 2018 Jan, DOI: 10.1038/s41419-017-0039-y, Vol. 9, pag. 42-42
FONDOS
Gracias por apoyarnos