Nuestro grupo utiliza el insecto Drosophila melanogaster para estudiar los mecanismos biológicos básicos en desarrollo y en enfermedades.
El grupo es parte de la Unidad Mixta UPV-CIPF, establecida en 2016 con el objetivo de incentivar la colaboración entre investigadores de ambas instituciones en los campos de la fisiopatología y la nanomedicina. Nuestro grupo utiliza el insecto Drosophila melanogaster para estudiar los mecanismos biológicos básicos en desarrollo y en enfermedades.
Utilizamos Drosophila para generar nuevos modelos de enfermedades raras, con particular interés en neuropatías periféricas hereditarias y en síndrome de Dravet y otras encefalopatías epilépticas raras. Nuestros objetivos son comprender los mecanismos de la enfermedad y generar nuevas herramientas para la búsqueda de nuevos biomarcadores y tratamientos. Para ello, tenemos una red de colaboraciones con otros grupos que trabajan en genética de Drosophila, fisiología y enfermedades raras; y estamos estableciendo nuevas colaboraciones con grupos clínicos y asociaciones de pacientes.
Con el fin de obtener modelos biomédicos útiles en el estudio de mecanismos de enfermedad y para el descubrimiento de nuevos biomarcadores y tratamientos, estamos utilizando técnicas de edición genómica. El objetivo es reemplazar el gen de Drosophila por su equivalente humano portando mutaciones clínicas descritas en pacientes. De esta forma, es posible llevar a cabo estrategias de medicina personalizada y de precisión.
Presentación
Conócenos mejor
Personal de investigación
El equipo que lo hace posible
Máximo Ibo Galindo Orozco
igalindo@cipf.es
Maria Del Carmen Martin Carrascosa
mcmartin@cipf.es
Christian Palacios Martínez
cpalacios@cipf.es
Publicaciones
Nuestro aporte a la ciencia
Oxidative Stress, a Crossroad Between Rare Diseases and Neurodegeneration.
Espinós C, Galindo MI, García-Gimeno MA, Ibáñez-Cabellos JS, Martínez-Rubio D, Millán JM, Rodrigo R, Sanz P, Seco-Cervera M, Sevilla T, Tapia A and Pallardó FV
Antioxidants, 2020 Apr, DOI: 10.3390/antiox9040313, Vol. 9, pag.
The Drosophila junctophilin gene is functionally equivalent to its four mammalian counterparts and is a modifier of a Huntingtin poly-Q expansion and the Notch pathway
E. CALPENA, V. DEL AMO, M. CHAKRABORTY, B. LLAMUSI, R. ARTERO, C. ESPINOS and M. GALINDO
Disease Models & Mechanisms, 2018 Jan, DOI: 10.1242/dmm.029082, Vol. 11, pag.
A Drosophila model of GDAP1 function reveals the involvement of insulin signalling in the mitochondria-dependent neuromuscular degeneration
V. DEL AMO, M. PALOMINO-SCHATZLEIN, M. SECO-CERVERA, J. GARCIA-GIMENEZ, F. PALLARDO, A. PINEDA-LUCENA and M. GALINDO
BIOCHIMICA ET BIOPHYSICA ACTA-MOLECULAR BASIS OF DISEASE, 2017 Mar, DOI: 10.1016/j.bbadis.2017.01.003, Vol. 1863, pag. 801-809
Evolutionary History of the Smyd Gene Family in Metazoans: A Framework to Identify the Orthologs of Human Smyd Genes in Drosophila and Other Animal Species
E. CALPENA, F. PALAU, Carmen Espinós and M. GALINDO
Plos One, 2015 Jul, DOI: 10.1371/journal.pone.0134106, Vol. 10, pag.
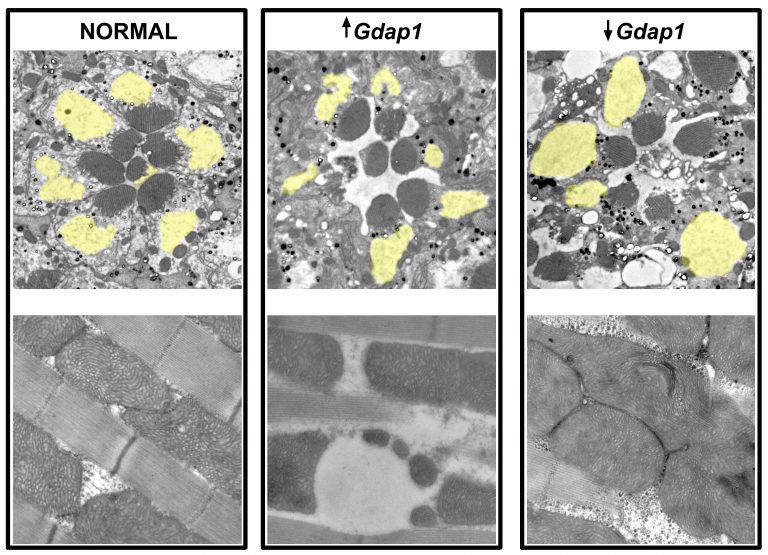
Mitochondrial defects and neuromuscular degeneration caused by altered expression of Drosophila Gdap1: implications for the Charcot-Marie-Tooth neuropathy
V. DEL AMO, M. SECO-CERVERA, J. GARCIA-GIMENEZ, A. WHITWORTH, F. PALLARDO and M. GALINDO
HUMAN MOLECULAR GENETICS, 2015 Jan, DOI: 10.1093/hmg/ddu416, Vol. 24, pag. 21-36
FONDOS
Gracias por apoyarnos